【発行国】日本国特許庁(JP)
【公報種別】特許公報(B2)
【特許番号】第2583183号
【登録日】平成8年(1996)11月21日
【発行日】平成9年(1997)2月19日
【発明の名称】生理活性を有するグリコーゲンの製法及び生理活性
【国際特許分類第6版】
A61K 31/715 ADU
// C08B 37/18
【FI】
A61K 31/715 ADU
C08B 37/18
【請求項の数】1
【全頁数】8
【出願番号】特願平5−64606
【出願日】平成5年(1993)2月12日
【公開番号】特開平6−279292
【公開日】平成6年(1994)10月4日
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り
平成4年10月11
日に開催された社団法人日本生化学会第65回大会において発表
【前置審査】 前置審査
【特許権者】
【識別番号】591005453
【氏名又は名称】青森県
【住所又は居所】青森県青森市長島1丁目1番1号
【特許権者】
【識別番号】593057229
【氏名又は名称】株式会社青森ともや
【住所又は居所】青森県青森市大字西田沢字沖津257―10
【発明者】
【氏名】高谷 芳明
【住所又は居所】青森県青森市大字八ッ役字芦谷202−4
青森県産業技術開発セン
ター内
【発明者】
【氏名】内沢 秀光
【住所又は居所】青森県青森市大字八ッ役字芦谷202−4
青森県産業技術開発セン
ター内
【発明者】
【氏名】松江 一
【住所又は居所】青森県青森市大字八ッ役字芦谷202−4
青森県産業技術開発セン
ター内
【発明者】
【氏名】佐々木 甚一
【住所又は居所】青森県弘前市在府町5 弘前大学医学部内
【発明者】
【氏名】石田 邦夫
【住所又は居所】青森県弘前市在府町5 弘前大学医学部内
【発明者】
【氏名】一戸 秀隆
【住所又は居所】青森県青森市大字西田沢字沖津257−10
株式会社青森ともや内
【代理人】
【弁理士】
【氏名又は名称】本橋 光一郎
【審査官】 松浦 新司
【参考文献】
【文献】特開 昭53−44614(JP,A)
【文献】特開 平2−268120(JP,A)
【文献】特開 昭61−53220(JP,A)
【特許請求の範囲】
【請求項1】
タンパク質分解酵素を用いて処理、抽出されたグリコーゲンを有効成分
とすることを特徴とする抗腫瘍剤
【発明の詳細な説明】
【0001】
【産業上の利用分野】本発明はグリコーゲンを有効成分とする抗腫瘍剤に関する。
【0002】
【従来の技術】医学、薬学分野の高度に発達した現代においても、ガンは人類の死亡原
因の第一位の座を一向に譲ろうとはしていない。そのため、ガン治療に関する研究は猶
も各分野において盛んに行われているところである。その結果、数多くの生命を救うこ
とのできた有効な薬剤、療法が生み出されたことは言うまでもない。特に化学療法剤に
ついては、その数たるや知る術もないほどである。しかしながら、従来の薬剤は、その
物質自体の持つ毒性或いはその物質が薬剤として作用するための機序故に引き起こされ
る副作用、或いは、有効症例に関する範囲の狭さ故に決定的なところを欠いているもの
である。そのため、目下、低毒性、ワイドスペクトルの薬剤が望まれているものである
。
【0003】
【発明が解決しようとする課題】そこで、本発明の目的は前記の欠点を除き、タンパク
質分解酵素等を用いて得られたグリコーゲンをガン患者に投与することにより、安全且
つ効率的にガンを治癒させる用法を提供することにある。
【0004】
【課題を解決するための手段】本発明者等は、通常食用に供されているホタテ、アワビ
、カキ等の貝類に多く含まれ、更に、動物のエネルギー源としてたいへん重要な役割を
果たしているグリコーゲンを、タンパク質分解酵素を用いることにより抽出し、且つそ
の得られたグリコーゲンの抗腫瘍活性に関する研究を行った結果、強い抗腫瘍活性があ
ることを見いだした。本物質には細胞毒性が見られないことより、従来の細胞毒性を有
する抗腫瘍剤とは作用機序が異なり、免疫機構、つまり、生体の本来持つべき自己防御
機構を活性化することにより腫瘍細胞に対する抵抗性を高め、その結果腫瘍細胞の増殖
を抑制し、更には治癒してしまうと考えられる。
【0005】本発明においては、以上のような性質を有するタンパク質分解酵素により
処理することにより得られるグリコーゲンを、高活性、且つ極めて安全性の高い画期的
な抗腫瘍剤としてガン治療に用いようとするものである。
【0006】グリコーゲンはデンプン、アミロペクチンと同様にD−グルコースより構
成される多糖であり、D−グルコースが、アルファ1−4結合でグリコシド結合した主
鎖中の数カ所にアルファ1−6結合でD−グルコースがグリコシド結合し、さらにその
D−グルコースにD−グルコースが、アルファ1−4結合でグリコシド結合した側鎖を
有する、樹枝状の複雑な構造を取っていることを特徴とするものである。グリコーゲン
は動物においては肝臓で生合成され一般にエネルギーの貯蔵、代謝に関与するたいへん
重要な化合物である。また、食品においては、魚介類、特にホタテ、カキ、アワビ等貝
類のうま味の中心を成す物質でもある。従って、本発明において用いるグリコーゲンの
起源は多種に亙り、容易に大量且つ安価に入手可能なものと考えられる。
【0007】上記の如く、グリコーゲンは、古くより周知の物質であるが、抗腫瘍剤と
して利用されている例はない。従来、グリコーゲンは強アルカリ或いは強酸を用いるこ
とにより抽出、構造研究が行なわれ、標品として利用且つ供給されてきた。しかし、こ
の抽出条件によると生体内で存在していた状態であるところの微細な分岐構造が失われ
てしまっている。
【0008】そこで本発明においてはこの化学的に過酷な条件で抽出する従来の方法に
代わり、タンパク質分解酵素を用いることにより生体内での機能を保持した状態での抽
出を可能ならしめることに成功した。すなわち、従来、強アルカリ、或いは強酸により
処理することにより除去していたタンパク質などの夾雑物質を、タンパク質分解酵素を
用いるという温和な条件により可能成らしめた。本発明においてグリコーゲンの抽出に
はタンパク質分解酵素として、好ましくはプロナーゼ、トリプシン、パパインを用いる
。グリコーゲンの抽出には、グリコーゲンが含まれていると考えられる試料を必要に応
じてアセトン或いはエタノール等の親水性有機溶剤と共に攪拌或いはホモジナイズする
ことにより脱脂乾燥して用いる。或は試料を冷水、熱水、各種緩衝液等中に浸漬、或い
は攪拌することにより得られる抽出液を、透析、限外濾過、電気透析等により脱塩し用
いる。上記処理を施した試料をトリス塩酸緩衝液などの、使用する酵素に至適の水素イ
オン濃度に調整した溶液に溶解し、酵素を添加作用させ、遠心分離後上清に、アルコー
ル等、好ましくはエタノールを加えることにより、グリコーゲンをほぼ純粋な状態で抽
出することが可能である。更に精製するためにはゲル濾過、イオン交換クロマトグラフ
ィ、或いは高速液体クロマトグラフィを用いることにより可能である。抗腫瘍効果は上
記粗抽出物の状態でも期待できるが、好ましくはゲル濾過及び陰イオン交換クロマトグ
ラフィにより高度に精製した状態により効率的且つ高い効果が得られる。グリコーゲン
は白色の粉末として得られ乾燥した状態では変質することもなく、且つ熱水或は高温の
蒸気による抽出によっても活性が保持されることより、熱安定性が極めて高いこどが確
認され、長期の保存が可能である。粗グリコーゲン及び精製されたグリコーゲンは共に
水及び各種緩衝液に易溶であるが、完全に透明な溶液とは成らず濾別不可能な白色のコ
ロイド状粒子により微かに白色を呈した溶液となる。
【0009】本発明の方法によって抽出分離精製されたグリコーゲンの性質は次のとお
りである。
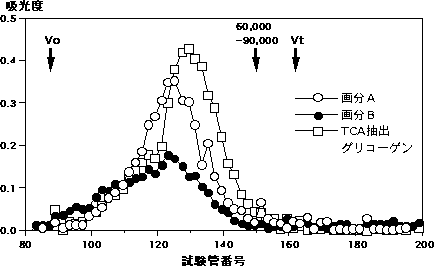
【0010】「平均分子量」図1の画分A、Bおよび従来法であるトリクロロ酢酸を用
いホタテ貝閉殻筋より抽出されたグリコーゲンをセファロース
CL−2Bゲル(商品
名、ファルマシア社製)を用いたゲルカラムクトマトグラフィにより分子量の比較を行
った結果、本発明の方法により得られたグリコーゲンはトリクロロ酢酸により抽出され
たグリコーゲンよりも平均分子量が大きく、10万以上であった(図2)。
【0011】「ベーターアミラーゼ限界分解率」ベーターアミラーゼによる限界分解率
はトリクロロ酢酸抽出グリコーゲンでは33%であったのに対し、本発明の方法により
得られたグリコーゲンは20%以下であった。
【0012】「単位平均鎖長」イソアミラーゼ処理後、全糖量を還元末端糖量で除する
ことによって、単位平均鎖長を求めた結果、トリクロロ酢酸抽出グリコーゲンでは9.
3であったのに対し、本発明の方法により得られたグリコーゲンは7.0であった。
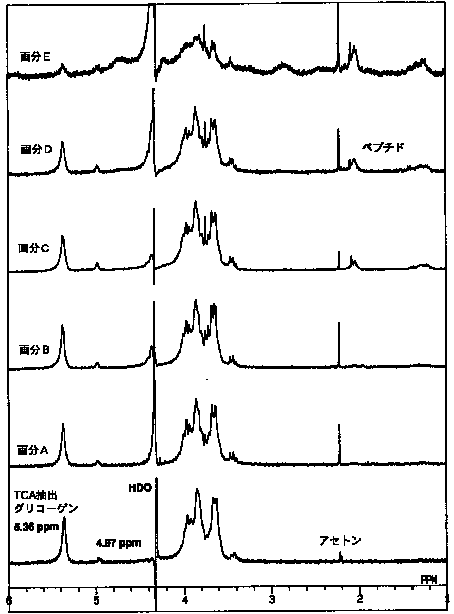
【0013】「プロトンNMR」図3に示した。
【0014】「化学成分分析値」表1に示した。
【表1】
蛋白質分解酵素法(酵素法)およびトリクロロ酢酸(TCA法)により
得られたグリコーゲンの化学組成
酵素法の画分AおよびBは図1のものと同一とする。
|
|
|
|||||||
|
|
|
|
|
|
グルコサミン |
ガラクトサミン |
|
|
|
TCA法 |
|
|
|
|
|
|
|
|
|
酵素法 |
||||||||
|
画分A |
|
|
|
|
|
|
|
|
|
画分B |
|
|
|
|
|
|
|
|
|
(μg/匹) |
|
|
(%) |
|
|
|
50 |
5 |
0 |
0 |
|
|
50 |
5 |
0 |
0 |
|
抽出グリコーゲン |
|
|
|
|
|
|
|
|
|
|

【図2】
Sepharose CL-2Bカラムによるグリコーゲン画分A、B
及びTCA抽出グリコーゲンの分子量算出
【図3】
図1中の画分A〜E及びTCA抽出グリコーゲンのプロトンNMRスペクトル
(270MHz、重水中、70℃)
【図面の簡単な説明】
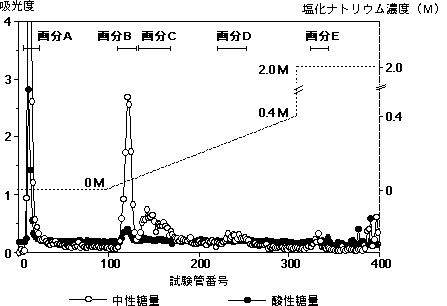
【図1】グリコーゲンをDEAEセファデックスA−25イオン交換カラムを用い、食
塩濃度を0M、0Mから0.4Mの直線濃度勾配法、および2Mと変化させ溶出させた
結果、画分A、B、C、D、Eの5つの画分が得られたことを表す図である。
【図2】グリコーゲンをセファロースCL−2Bカラムに供し溶出させることにより、
トリクロロ酢酸を用いて抽出したグリコーゲンとの分子量の比較を行った結果を表す図
であり、本発明において得られたグリコーゲンはトリクロロ酢酸を用いて抽出したもの
に比較し分子量が大きいことを示す図である。
【図3】図1中の画分A〜Eおよびトリクロロ酢酸を用いて抽出したグリコーゲンの、
270MHz、重水中、70゜Cの条件下でのプロトンNMRスペクトルを表す図であ
る。
───────────────────────────────────────
参考文献 特開 昭53−44614(JP,A)
特開 平2−268120(JP,A)
特開 昭61−53220(JP,A)